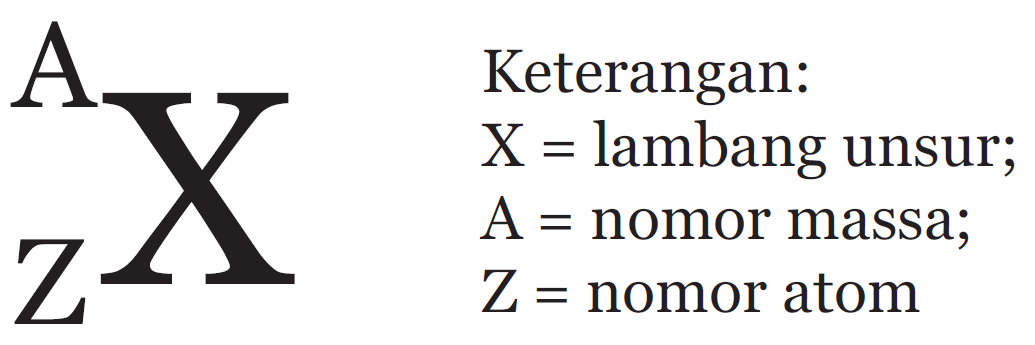Kompetensi Dasar :
Pengetahuan
3.8. Menghubungkan konsep partikel materi (atom, ion, molekul), struktur zat sederhana dengan sifat bahan yang digunakan dalam kehidupan sehari-hari, serta dampak penggunaannya terhadap kesehatan manusia.
Keterampilan
4.8. Menyajikan hasil penyelidikan tentang sifat dan pemanfaatan bahan dalam kehidupan sehari - hari.
Tujuan Pembelajaran :
Setelah mengikuti proses pembelajaran daring, peserta didik dapat :
1. Menganalisis konfigurasi elektron suatu atom dengan benar.
2. Menganalisis cara-cara atom mencapai kestabilan dengan benar.
Assalamualaikum Wr. Wb
Anak-anak, sebelum kita belajar IPA hari ini, jangan lupa untuk berdoa terlebih dahulu. Dengan doa dan upaya kalian yang sungguh-sungguh, Pak Arief yakin kalian akan mampu menguasai materi hari ini. Berikut Peta Konsep materi yang akan kita pelajari.
PETA KONSEP
APERSEPSI
Sebelum melanjutkan membaca ringkasan materi, silakan disimak dulu video berikut ini untuk memberikan gambaran mengenai materi yang akan kita pelajari.
RINGKASAN MATERI
A. Prinsip Pembentukan Molekul dan Ion
Untuk memahami lebih lanjut mengenai prinsip pembentukan molekul ada 3 hal yang harus dikuasi yaitu konfigurasi elektron, ion dan indentifikasi unsur.
1. Konfigurasi Elektron
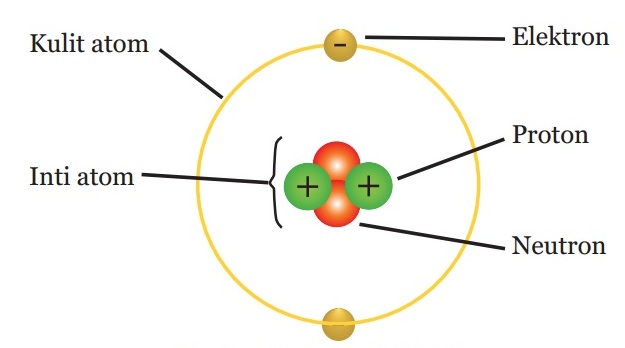
- Konfigurasi elektron adalah susunan elektron di dalam suatu atom.
- Sebagaimana dijelaskan pada model atom, atom mempunyai tingkat-tingkat energi yang menurut Bohr disebut kulit-kulit atom.
- kulit K (n=1)
- kulit L (n=2),
- kulit M (n=3) dan seterusnya.
 |
| Tingkat Energi Atom dan Jumlah Elektron Maksimal |
- Penentuan konfigurasi elektron cara per kulit didasarkan pada jumlah elektron yang dapat mengisi setiap kulit.
- Pengisian elektron pada kulit-kulit atom dimulai dari pengisian kulit terdalam atau yang mempunyai energi paling rendah.
- Jumlah maksimum elektron yang dapat mengisi setiap kulit dirumuskan: 2n2 (n = kulit yang ditempati elektron)
- Jumlah elektron maksimum yang dapat ditempati pada setiap kulit adalah:
a. Cara menentukan konfigurasi elektron suatu atom dengan nomor atom 1–20.
- Kulit pertama (kulit K) maksimum ditempati 2 elektron.
- Kulit kedua (kulit L) dan ketiga (kulit M) maksimum ditempati 8 elektron.
- Kulit keempat (kulit N) maksimum ditempati 18 elektron.
- Penempatan elektron dimulai dari kulit pertama, kedua, ketiga, dan seterusnya.
Contoh Soal:
Tentukanlah konfigurasi elektron atom-atom berikut.
1. O (nomor atom = 8 )
2. Na (nomor atom = 11)
3. S (nomor atom = 16)
4. Ca (nomor atom = 20)
Jawab:
1. Nomor atom O = 8
- kulit K terisi 2 elektron
- kulit L terisi 6 elektron
Jadi, konfigurasinya 2 6. Elektron pada atom O mengisi 2 lintasan/kulit yaitu K dan L. Untuk memudahkan pengerjaan, jawaban dapat ditulis seperti tabel berikut.

b. Cara menentukan konfigurasi elektron suatu atom dengan nomor atom > 20.
- Kulit pertama (kulit K) dan kulit kedua (kulit L) diisi dengan jumlah elektron maksimum terlebih dahulu.
- Kulit ketiga (kulit M) diisi dengan jumlah elektron:
- 18 jika : elektron yang tersisa > 18
- 8 jika : 8 ≤ elektron yang tersisa < 18
- sisa jika : elektron yang tersisa < 8
- Kulit keempat (kulit N) diisi dengan jumlah elektron:
- 32 jika : elektron yang tersisa > 32
- 18 jika : 18 ≤ elektron yang tersisa < 32
- 8 jika : 8 ≤ elektron yang tersisa < 18
- sisa jika : elektron yang tersisa < 8
Contoh Soal:
Tentukanlah konfigurasi elektron atom-atom berikut.
1. Ge (nomor atom = 32)
2. Se (nomor atom = 34)
3. Sr (nomor atom = 38)
4. Ra (nomor atom = 88)
Jawab:
1. Nomor atom Ge = 32
- kulit K = 2 (maksimum)
- kulit L = 8 (maksimum)
- kulit M = 18 (maksimum)
- kulit N = 4 (sisa)
Jadi, konfigurasinya 2 8 18 4. Elektron pada atom Ge mengisi 4 lintasan/kulit yaitu K, L, M, dan N.
Untuk memudahkan pengerjaan, jawaban dapat ditulis seperti tabel berikut.

Contoh lain dapat disimak pada tabel berikut:
- Jumlah lintasan/kulit atom yang dimiliki suatu atom berhubungan dengan periode atom tersebut dalam tabel periodik.
- Jumlah elektron pada lintasan terakhir suatu atom disebut dengan elektron terluar (elektron valensi). Elektron valensi berhubungan dengan nomor golongan atom.
2. Ion
a. Konsep Ion
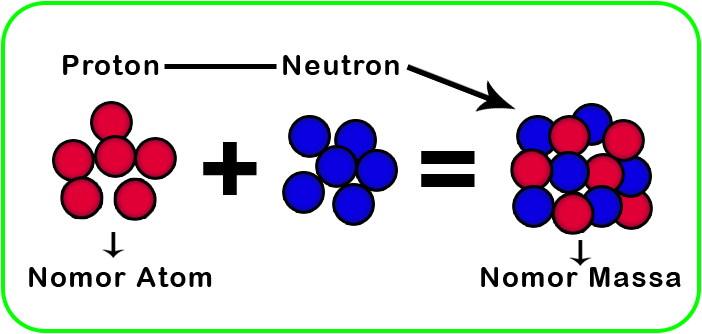
- Ion adalah atom atau molekul yang memiliki jumlah total elektron yang tidak sama dengan jumlah total protonnya.
- Bila jumlah elektron dan jumlah proton dalam suatu atom tidak sama, atom tersebut akan bermuatan atau menjadi ion. Proses pembentukan ion itu disebut ionisasi.
- Ion yang bermuatan positif disebut kation, sedangkan ion yang bermuatan negatif disebut anion
- Tabel berikut menyajikan contoh atom dan ion.
- Untuk ion (atom bermuatan positif atau negatif) maka notasi ion, jumlah proton, neutron, dan elektron adalah:
Keterangan:
X = lambang unsur
A = nomor massa
Z = nomor atom
p = proton
n = neutron
e = elektron
q = nilai ion positif
r = nilai ion negatif
Catatan:
- Untuk atom netral, jumlah proton sama dengan jumlah elektron.
- Untuk ion positif, jumlah proton (muatan positif) lebih banyak daripada elektron (muatan negatif).
- Untuk ion negatif, jumlah elektron (muatan negatif) lebih banyak daripada proton (muatan positif).
Contoh Soal:
1. 126C mempunyai jumlah proton, neutron, dan elektron sebagai berikut.
- p = Z = 6
- n = A – Z = 12 – 6 = 6
- Karena atom netral (tak bermuatan) maka: e = p = 6.
2. Ion 199F − mempunyai jumlah proton, neutron, dan elektron sebagai berikut.
- p = Z = 9
- n = A – Z = 19 – 9 = 10
- Karena muatan F adalah – artinya bernilai –1 maka r = 1, sehingga: e = p + r = 9 + 1 = 10
3. Ion 8838Sr 2+ mempunyai jumlah proton, neutron, dan elektron sebagai berikut.
- p = Z = 38
- n = A – Z = 88 – 38 = 50
- Karena muatan Sr adalah 2+, maka q = 2 sehingga: e = p – q = 38 – 2 = 36
b. Konfigurasi Elektron pada Ion
Di antara atom-atom di alam, hanya atom gas mulia yang stabil sedangkan atom yang lain tidak stabil.

Dari konfigurasi elektron gas mulia di atas, maka konfigurasi elektron atom-atom akan stabil jika jumlah elektron valensinya berjumlah 2 (untuk kulit K) dan 8 (untuk kulit lainnya).
Pada atom-atom yang memiliki elektron valensi yang tidak mencapai kestabilan konfigurasi elektron gas mulia, maka atom tersebut akan mengalami lepas dan terima elektron.
- Atom yang memiliki elektron valensi 1, 2, dan 3 cenderung melepaskan elektron.
- Atom yang memiliki elektron valensi 4, 5, 6 dan 7 cenderung mengikat atau menerima elektron.

- Contoh:
3. Identifikasi Unsur
- Kembang api mengandung senyawa tertentu yang apabila dibakar molekul di dalamnya akan menyerap energi dan menyebabkan elektron-elektron pada atomnya mengalami perpindahan antar kulit atom.
- Perpindahan elektron dari kulit yang rendah ke tinggi ini membutuhkan energi sehingga terjadi penyerapan energi, sedangkan perpindahan kulit elektron dari yang tinggi ke rendah akan melepaskan energi.
- Energi yang dilepas ini akan terlibat sebagai cahaya seperti pada kembang api. Dimana, masing-masing atom mempunyai jarak antarkulit atom yang berbeda sehingga energi yang diserap atau dilepaskan juga akan berbeda dan mengakibatkan perbedaan warna cahaya.
- Warna khas yang dihasilkan suatu unsur dapat digunakan untuk mencari tahu keberadaan suatu unsur dalam suatu materi secara kualitatif atau mengidentifikasi kadar suatu suatu unsur pada suatu bahan.
REFERENSI
- Video referensi : Beberapa video referensi terkait materi bisa dilihat dengan cara klik pada gambar.
LATIHAN SOAL
Setelah mempelajari materi ini, sekarang ayo dicoba untuk mengerjakan latihan soalnya.
Catatan :
Format Penulisan Identitas untuk mengerjakan latihan soal :
"Nama Lengkap/Kelas"
Contoh : Adellia Larasati/9A
~ Tetap Semangat Belajar IPA #dirumahaja ~